放射光を用いた新技術でアミロイド線維の微細溶液構造を初めて解明
-アルツハイマー病などの疾患原因蛋白質の構造・機能研究への応用に期待-
ポイント
- アルツハイマー病などの疾患原因物質であるアミロイド線維*1の放射光*2円二色性*3観測とその理論解析に世界で初めて成功
- アミロイド線維の形態・毒性に重要な分子間微細構造を生理的条件下で初めて解明
- これまで未解明であった疾患原因蛋白質の溶液構造とその機能研究に強力な新手法を構築
概要
国立大学法人広島大学放射光科学研究センター(以下「HiSOR」という)松尾光一助教、同大学月向邦彦名誉教授、東北大学大学院薬学研究科平松弘嗣助教、アメリカコロラド州立大学生化学・分子生物学部Robert W. Woody教授のグループを中心とする国際共同研究チームは、HiSORの放射光円二色性装置を用いて、アルツハイマー病*4や透析アミロイド症*5等の原因物質であるアミロイド線維の微細構造を、結晶化させることなく、生理的条件下で解明することに世界で初めて成功しました。
アミロイド線維は蛋白質*6あるいはペプチド*7が積み重なった会合体*8で、結晶・固体状態での三次元構造はX線結晶学等により原子レベルで研究されています。しかし、生理的環境に近い溶液中の構造については、人体に対する線維の毒性を議論する上で重要にも関わらず不明な点が多く残されています。蛋白質やペプチドの溶液構造を知る有力な方法として、円二色性分光がありますが、これまではデータベースに依存した経験的な解析法しか確立されておらず、得られる蛋白質の溶液構造に関する情報は二次構造*9までに限定されていました。本研究では、透析アミロイド症に関わるヒト由来の蛋白質コアペプチドのアミロイド線維の円二色性を測定し、原子レベルの三次元構造情報と分子動力法学*10を用いて理論的に解析することで、水中でのアミロイド線維の形態・毒性を決定するアミノ酸側鎖*11の微細溶液構造を世界で初めて明らかにすることに成功しました。
今回の成果は、20種以上あるアミロイドーシス*12のアミロイド線維の形成機構を解明するための重要な成果であるだけでなく、アミロイド線維が引き起こす疾患の新規治療法や診断法の開発に貢献すると期待されます。また本手法は、スーパーコンピューター*13による網羅的計算法を活用することで、酵素改変*14によって生じる毒性と構造との関連性についての迅速な解析や、生命機能に極めて重要な蛋白質と蛋白質、および蛋白質とホルモン・細胞膜・糖鎖・DNA等との結合体(蛋白質複合体)の分子間微細構造の基盤解析技術となるため、疾患原因蛋白質を中心とした蛋白質の構造・機能研究の新手法として広い応用が期待されます。この新技術は、蛋白質だけでなく、ほとんどの生体分子に適用できる画期的な手法であり、構造生物学にブレークスルーを与えるものです。
なお、本研究成果は、平成26年3月20日(木)発行のアメリカ化学会誌「Journal Physical Chemistry B」に掲載される予定で、オンライン版では平成26年2月25日(火)より公開されております。
論文タイトル:‘Characterization of intermolecular structure of b2-microglobulin core fragments in amyloid fibrils by vacuum-ultraviolet circular dichroism spectroscopy and circular dichroism theory’
著者:Koichi Matsuo, Hirotsugu Hiramatsu, Kunihiko Gekko, Hirofumi Namatame, Masaki Taniguchi, Robert W. Woody
URL:http://pubs.acs.org/doi/full/10.1021/jp409630u
広島大学お知らせ
[研究成果]HiSORを用いて、アルツハイマー病などの疾患原因タンパク質の解析に世界で初めて成功〜構造生物学にブレークスルーを与える新手法〜
背景
蛋白質の立体構造は、その生物学的機能の解明や創薬の研究開発を行う上で極めて重要であり、放射光によるX線回折法や核磁気共鳴法から求めた原子レベルの構造情報が広く利用されています。これらの方法は、蛋白質を結晶化する必要があったり、解析できる分子量に限界があるなど実験条件に制約があり、疾患の原因に深く関わるアミロイド線維のような複雑な蛋白質の構造・機能の研究に適用するのは難しい状況です。一方、生体分子が持つ対掌性*3に基づいた円二色性分光法は、実験条件の制約がほとんど無いため汎用性は極めて高く、蛋白質の構造解析に広く用いられています。しかし、市販光源では限られた波長領域の円二色性データしか収集できず、また、データ解析においても、種々の蛋白質の円二色性データベースとの比較から、二次構造(ヘリックス・シート)含量といった限定的な情報しか得ることができません(図1a)。しかし最近、近紫外から真空紫外領域までの広波長領域で蛋白質の円二色性が観測できる放射光装置が開発され、また、これらのスペクトルを理論的に解釈する解析手法が飛躍的に発展しました。
このような背景のもと、我々の研究チームは、HiSORの放射光を用いた世界最高水準の円二色性装置と最新の蛋白質円二色性理論とを組み合わせることで、水中での構造解析が困難とされていたアミロイド線維の三次構造に関する情報を獲得し、線維の形態・毒性を決定する分子間の微細構造の解明を行いました(図1b)。
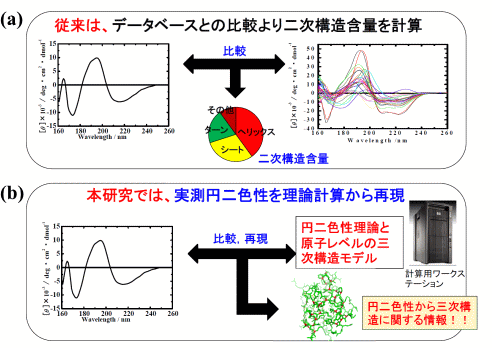
図1 (a)円二色性による従来の蛋白質の構造解析法と(b)今回発表した新しい構造解析法
(a) 従来の方法では、実験円二色性データと経験的に得た蛋白質二次構造の円二色性データベースとを比較することで、二次構造のみの情報を得ていた。(b) 今回の成果は、実測円二色性スペクトルを原子レベルの三次構造モデルを基に理論解析し、構造情報を三次構造に近い微細構造にまで拡張することができる。
研究手法と成果
今回、我々の研究チームは、HiSORの放射光円二色性装置を用いて、透析アミロイド病に関わる人由来の蛋白質(β2ミクログロブリン)のコアペプチドを会合させアミロイド線維を作成し、近紫外から真空紫外領域までの円二色性を高精度で観測しました。その結果、アミロイド線維の円二色性が、全観測領域において二次構造だけでなく三次構造(芳香族アミノ酸側鎖)の影響を強く受けることを確認しました。そこで、このコアペプチドから形成可能なアミロイド線維のモデル構造を網羅的に構築し、これらの原子レベルでの三次構造モデルを基に、円二色性理論と分子動力学とを組み合わせて円二色性スペクトルを計算し、実験データと比較しました。構造モデルを変えながら実験と理論との詳細な比較を行った結果、アミロイド線維の主成分であるβシートが逆平行で積み重なった構造(図2)が最も良く実験結果を説明できることが明らかとなりました(図3a)。さらに、アミロイド線維内の分子間には、芳香族アミノ酸側鎖が3種類の配向パターンで存在することが分かり(図3b)、このパターンの違いがアミロイド線維の性質を決定づけることが明らかになりました。
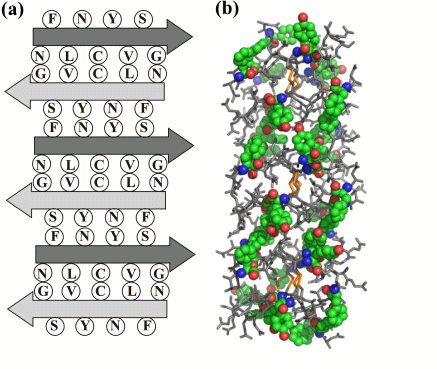
図2 (a)アミロイド線維の円二色性を理論的に説明できるモデル構造と(b)分子動力学によって得られた三次構造
(a) モデル構造は9残基のアミノ酸配列(NFLNCYVSG)のペプチドから成る。矢印は、ペプチドが形成するシート構造の方向(N端→C端)を示す。各ペプチドが逆方向に積み重なりアミロイド線維を形成している。
(b) 芳香族アミノ酸側鎖(F:フェニルアラニン,Y:チロシン)がカラーで示されている。緑色、炭素原子;赤色、酸素原子;青色、窒素原子。ペプチド間の芳香族アミノ酸側鎖の配向により線維が安定化している。
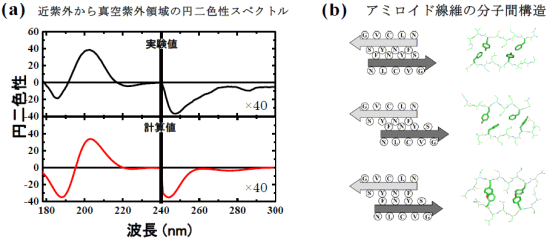
図3 (a)アミロイド線維の近紫外から真空紫外領域の実測円二色性スペクトルと図2の三次構造から得られた理論円二色性スペクトル及び(b)アミロイド線維内の分子間に存在する芳香族アミノ酸側鎖の微細構造(配向パターン)
(a) 図2の三次構造モデルから得た理論円二色性が実測円二色性を再現する。(b) 左図は、芳香族アミノ酸側鎖の3種類の配向パターンの概略図。右図は、これら配向パターンの三次構造。太線が芳香族アミノ酸側鎖を示している。
研究成果の意義
アミロイドーシスに関わる疾患は、人由来のもので20種類以上報告されていますが、この疾患原因となるアミロイド線維の構造と毒性については、溶液構造の解析が困難なため、多くが未解明のままです。円二色性法は、微量なサンプル量(数マイクロリットル)で測定できるため、本研究成果により、患者から直接採取した微量なアミロイド線維の溶液中の三次構造と毒性との関連性を明確にできると期待されます。また、円二色性は短時間で容易に測定できる利点を持つため、本研究の成果から、例えば毒性の高いアミロイド線維のアミノ酸配列(アミノ酸置換)に依存する分子間構造やその形成・制御機構解明に向けた網羅的研究が迅速に進められると考えられ、アミロイドーシスに関わる新規治療法や診断法の開発に弾みがつくと期待されます。さらに、円二色性法は、蛋白質を結晶化せずに溶液中で構造を解析できる大きなメリットがあり、また扱える分子量にも制限がないため、幅広い実験条件に対応できます。そのため今回の研究成果は、アミロイド線維だけでなく、生命機能に極めて重要な蛋白質と蛋白質、および蛋白質とホルモン・細胞膜・糖鎖・DNA等との結合体(蛋白質複合体)の分子間微細構造の基盤解析技術となります。この新技術は、蛋白質だけでなく、ほとんどの生体分子に適用できる画期的な手法であり、構造生物学にブレークスルーを与えるものです。
研究体制
本研究成果は、日本学術振興会の科学研究費補助金:若手研究(A)「放射光真空紫外円二色性による蛋白質構造解析の新展開」(平成22〜26年度、研究代表者:松尾光一)の援助を受けている。本研究は、HiSORでの研究課題(課題番号09-A-37)で実験が行われた。
用語解説
- *1 アミロイド線維
- クロスβシートという特定の構造を持つ線維状の蛋白質である。蛋白質のβシート構造が積み重なることで形成される。幅は約10nmで、枝分かれのない線維構造をつくっている。 戻る
- *2 放射光
- 光速で直進する電子の進行方向が磁石などによって変えられた際に発生する電磁波。真空紫外領域からX線にわたる強力な光源であり、固体物理や生体分子構造解析等の物理・生物・化学・電子工業分野で広く利用されている。 戻る
- *3 円二色性
- 円二色性は、分子に左円偏光と右円偏光の光が通過した時、各偏光で吸収の差が生じる現象をいう(下図)。ほぼすべての生体分子が円二色性を示すため、円二色性法は、生体分子の構造解析に広く利用されている。

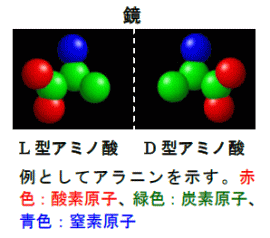
円二色性は、対掌性分子が持つ固有の性質である。対掌性は、人の左右の掌の関係性を示す表現で、三次元の図形や物体が、その鏡像と重ね合わすことができない性質。この関係性は分子レベルにも存在し、例えば、蛋白質を構成するアミノ酸には、D型とL型の2種類があるが、両構造は重ね合わせることができない(下図)。 戻る
- *4 アルツハイマー病
- 認知症の一種であり、脳内にアミロイドβと呼ばれる蛋白質が蓄積することが原因で発症する。 戻る
- *5 透析アミロイド症
- 人工透析により体内で増加したβ2ミクログロブリンがアミロイド線維を作り、神経や関節などに沈着して関節炎や麻痺などを起こす疾患。 戻る
- *6 蛋白質
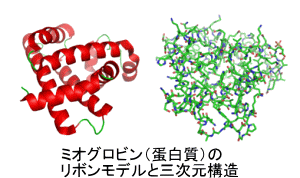
- 生体の主要構成成分で、20種類のL型アミノ酸がペプチド結合によって連結した一本鎖ポリペプチド。アミノ酸の並び方やその長さに依存して、形成される立体構造が異なる。右図は、例として蛋白質であるミオグロビンのリボンモデルと三次元構造を描いている。 戻る
- *7 ペプチド
- 蛋白質を消化酵素等で加水分解した時に生成される断片。 戻る
- *8 会合体
- 同種の分子2個以上が比較的弱い分子間力によって集合し,一つの形態を形成している状態。 戻る
- *9 二次構造
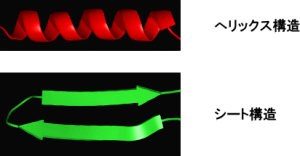
- 蛋白質のペプチド結合間の水素結合によって形成される比較的狭い範囲にみられる規則的構造。主に、バネに似た右巻らせん構造を示すへリックス構造と全体として平面構造をとるシート構造がある。従来の円二色性法は、蛋白質内の二次構造の含量しか分からなかったが、真空紫外領域まで測定波長を広げることにより、その位置や長さまで見積もることが可能となった。 戻る
- *10 分子動力学法
- コンピューター上で、物質が持つ物性値を分子に与え数値化し、計算により分子の動きを解析することである。生体分子の立体構造の予測、生体分子間相互作用の予測、進化のモデリングなどに利用されている。 戻る
- *11 アミノ酸側鎖
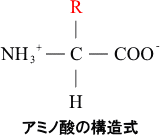
- アミノ酸は、アミノ基とカルボキシル基の両方の官能基を持つ有機化合物であり下図のような骨格を持つ。アミノ酸は20種類あり、”R”の官能基だけが異なっている。この”R”を側鎖と言い、疎水性・親水性・塩基性・酸性の種類がある。 戻る
- *12 アミロイドーシス
- アミロイド線維が全身の臓器の細胞外に沈着する疾患。アルツハイマー病、透析アミロイド症、甲状腺髄様癌、ALアミロイドーシス、パーキンソン病、狂牛病、クロイツフェルトヤコブ病などがある。 戻る
- *13 スーパーコンピューター
- 計算処理能力が極めて高いコンピューターのことを言う。最近ではスーパーコンピューター「京」に代表されるように、その計算能力が日進月歩で進化しており、蛋白質の分子動力学といった膨大な原子を扱う計算科学に、非常に有効な手段となる。 戻る
- *14 酵素改変
- 蛋白質(酵素)あるいはペプチドを構成する特定のアミノ酸を遺伝子工学的に他のアミノ酸に改変したもの。この改変により、蛋白質の構造や機能に大きな影響を持つアミノ酸部位を知ることができ、新機能蛋白質やペプチドの創製が可能となる。 戻る











