タンパク質が生体膜に作用する際の動的な構造変化の初観測
― 生体膜上でおこる複雑な生命現象の解明に期待―
【本研究成果のポイント】
- ●タンパク質と細胞を構成する生体膜を効率良く混合できる小型デバイスを開発
- ●生体膜に作用しながら変化するタンパク質の構造を分子レベルで可視化
- ●生体膜上で起こる様々な生命現象の発生メカニズムの解明に期待
【概要】
広島大学大学院先進理工系科学研究科の橋本聡大学院生と同放射光科学研究所(以下「HiSOR」という)の松尾光一准教授は、タンパク質溶液と生体膜溶液を、低容量でかつ効率よく混合できるマイクロ流路デバイスを開発し、放射光(注1)を利用した 真空紫外円二色性装置(注2)に設置することで、タンパク質が生体膜と相互作用する際の動的な構造変化を、ミリ秒~分の幅広い時間領域で可視化することに成功しま した。
生体膜に結合するタンパク質(膜結合タンパク質)は、パーキンソン病(注3)、多発硬化症(注4)などの疾患や、バクテリアに対する抗菌性機能、細胞内への薬物輸送 機能など多岐にわたる重要な生命現象に関わっており、これら現象の発生メカニズムを分子レベルで解明するためには、タンパク質が生体膜と相互作用する際の動的な構 造変化の様子を可視化することが必要でした。本研究グループは、異なる2種類の生 体試料溶液(タンパク質溶液と生体膜溶液)を効率よく混合できるマイクロ流路デバイスを構築し、放射光を利用した真空紫外円二色性分散計に設置することで、タンパク質が生体膜と相互作用する際の動的な構造変化の可視化に成功しました(図1)。本観測装置は、タンパク質、多糖類、核酸などの生体物質の様々な組み合わせに応用できるため、その用途は限りなく広く、生体膜上でおこる疾患原因物質の形成・抗菌性 機能・細胞内物質輸送などの複雑な生命現象の解明に貢献すると期待されます。
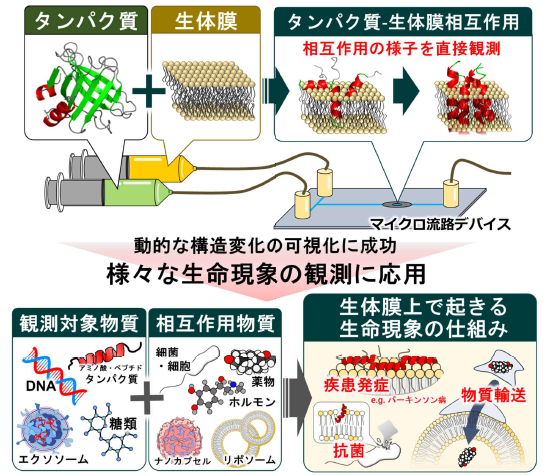
図1 マイクロ流路デバイスの開発により可能となったタンパク質が生体膜と相互作用する際の動的な構造変化の可視化と、応用研究が期待される疾患・抗菌・物質輸送などに関わる様々な生命現象
本研究成果は、米国の科学誌「Analytical Chemistry」に2024年6月22日付で オンライン掲載されました。
本研究は、科学研究費助成事業(課題番号:22K06163、23H04597)による支援を受けて実施されました。また、本研究は、HiSOR の共同研究委員会により採択さ れた研究課題(課題番号:21AU009、22AG014)として実験が行われました。
掲載雑誌:Analytical Chemistry(Q1), 96, 10524 (2024).
論文タイトル:“Dynamic Observation of the Membrane Interaction Processes of β -Lactoglobulin by Time-Resolved Vacuum-Ultraviolet Circular Dichroism”
著者:Satoshi Hashimoto and Koichi Matsuo
掲載日:2024年6月22日
DOI:https://doi.org/10.1021/acs.analchem.4c00556
URL:https://pubs.acs.org/doi/10.1021/acs.analchem.4c00556
広島大学お知らせ
【研究成果】タンパク質が生体膜に作用する際の動的な構造変化の初観測 ー生体膜上でおこる複雑な生命現象の解明に期待ー
【研究の背景】
タンパク質は、様々な生物学的な機能の発生に関与しており、これらの発生メカニズムを理解するために、タンパク質固有の天然構造を解明することが重要となっています。一方、タンパク質は、溶媒環境の変化や他の生体物質との相互作用により、その天然構造の形を変え、異なる機能や性質を持つことがあります。生体内環境下に近い水溶液中で、生体膜に相互作用するタンパク質(膜結合タンパク質)はこの一例であり、膜との相互作用によって天然構造から新たな構造(膜結合構造)に変化することで、パーキンソン病などの疾患原因物質の形成、薬物輸送や抗菌性などの機能や性質の発生に関わります。
当研究グループでは、タンパク質のキラリティ(注5)を市販の装置では測定できない波長領域まで検出できる放射光を光源とした真空紫外円二色性(以下、「VUVCD」という)分散計を用いて、生体内環境下に近い水溶液中におけるタンパク質の構造研究を行っています。本分光法から得られるタンパク質の構造情報を、機械学習法であるニューラルネットワーク(注6)法(以下、「VUVCD-NN 法」という)に入力する ことで、タンパク質のαヘリックス構造やβストランド構造などの規則構造(注7)が、アミノ酸配列(注8)上のどの位置に形成されるかを予測できます。これまでにVUVCD 分光法は、いくつかの膜結合タンパク質に応用され、その構造の解明に成功してきましたが、研究対象は、生体膜との相互作用する前後の静的な構造情報のみに限られており、相互作用する際にタンパク質がどのような構造状態を経由するのか、どのような駆動力が働いているのか、といった動的な情報の取得が困難でした。これを可能にするため、タンパク質と生体膜を効率よく混合できる手法を確立することが期待されていました。
本研究では、異なる2種類の生体試料の溶液(タンパク質溶液と生体膜溶液)を効率よく混合できるマイクロ流路デバイスを構築し、これをVUVCD装置に設置することで、生体膜と相互作用する際のタンパク質の動きを観測することを目指しました。また応用研究として、膜成分である脂質分子などの化合物を輸送するタンパク質であるβ-ラクトグロブリン(以下、「bLG」という)をマイクロ流路デバイスに注入し、bLGの生体膜との相互作用メカニズムの解明を試みました。
【研究の成果】
本測定システムは溶液を送り出すシリンジポンプ、マイクロ流路デバイス、放射光の大きさを微小化する集光レンズなどの光学系、放射光の強度を計測する検出器により構成されます(図2)。今回開発した本測定システムを使用し、生体膜と相互作用を開始した後のbLG のスペクトルを1-60 秒の時間領域で観測しました(図3A)。またこの結果から、相互作用の過程で一時的に現れる一つの中間体の構造情報を抽出することに成功しました(図3B、灰色線)。
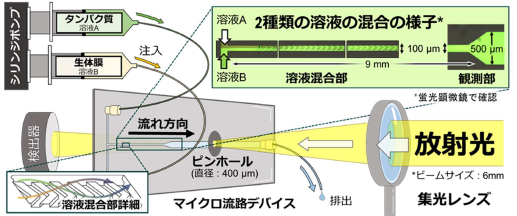
図2 測定システムの概略図。2種類の異なる溶液Aと溶液Bは、シリンジポンプの各シリンジから送液チューブを通じてマイクロ流路デバイス内に注入され、効率よく混合される。放射光は集光レンズにより微小化され、流路デバイスのピンホールと混合溶液を通過し、検出器に到達する。2種類の溶液の反応時間はシリンジポンプの流速により制御できる。
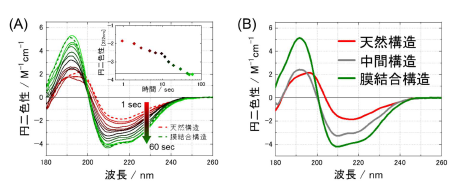
図3 (A)相互作用開始直後から終了(1~60sec)までのスペクトル変化。点線は相互作用前後の 構造を示す。190nmの正のピーク、208nm、222nmの負のピークは、αヘッリクス構造の寄与によるものであり、時間経過と共にピーク強度が顕著に増加する。(B)bLG の天然・膜結合構造及び、解析により得られた相互作用の過程で形成される中間構造のスペクトル。
図3Bに示すスペクトルよりbLG の各構造でのαヘリックス構造やβストランド構造などの規則構造の含量と本数の計算、そしてアミノ酸配列レベルでの位置予測を行うことで、天然→中間→膜結合構造の段階的な変化が明らかとなり、タンパク質が生体膜に作用するメカニズムを考察することが可能となりました。予測されたαヘリックス構造の位置(図4)や電荷、疎水性、両親媒性(注9)などの物性値を評価することで、静電的相互作用や疎水的相互作用(注10)といった重要な駆動力が生体膜相互作用の過程でどのように作用しているかが明らかになりました。
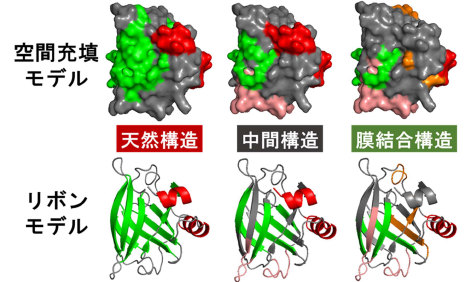
図4 各構造の二次構造情報を立体構造モデル(bLG の天然構造)へ反映。βストランド構造は緑色、αヘリックス構造は天然構造で赤色、中間構造で桃色、膜結合構造で橙色に着色した。
【今後の展開】
本研究グループが開発したマイクロ流路デバイスは、タンパク質溶液と生体膜溶液を効率良く混合できるため、タンパク質が生体膜と相互作用する際の動的な構造変化を追跡でき、可視化することができます。このような構造変化の情報は、生体膜との相互作用によりタンパク質がもたらす、疾患原因物質の形成、膜不安定化による抗菌機能、膜内への物質輸送などの多様な生命現象の発生メカニズムを分子レベルで解明する研究に応用できます。またマイクロ流路デバイスは、タンパク質や生体膜だけでなく、多糖類や核酸などの様々な生体分子やエクソソーム、ナノカプセルなども対象にできるため(図1)、将来的には、医歯薬分野において様々な疾患の研究、治療法や各種検査薬の開発への応用、有機物はもとより金属などの無機物の取り込みができるデバイス開発など、様々な応用研究に貢献できると期待されます。
【用語解説】
- 注1 放射光
- ほぼ光速で直進する電子の進行方向が磁石などによって変えられた際に発生する電磁波であり、シンクロトロン放射とも呼ばれます。赤外からX 線にわたる強力な光源であり、固体物理や生体物質構造研究をはじめ、物理・生物・化学などの分野を問わず広く利用されています。戻る
- 注2 真空紫外円二色性分光法
- 円二色性とは、キラリティを持つタンパク質などの生体分子が示す性質で、左円偏光と右円偏光と呼ばれる特殊な光の吸収量に差が生じる現象のことを指します。光の波長を変えながら円二色性の大きさや符号を測ったものを円二色性スペクトルと呼びます。タンパク質の円二色性スペクトルの形状はその構造を反映するので、様々な条件で測定した円二色性スペクトルを比較することで、それらのタンパク質の構造に差異があるかどうかを知ることができます。本研究で用いた真空紫外円二色性分光法は、光源に放射光を用いており、市販の装置では測定困難な高エネルギー領域である真空紫外領域まで円二色性スペクトルの測定範囲を広げることが可能であり、従来よりも詳細で新規な構造情報を得ることができます。戻る
- 注3 パーキンソン病
- 歩行しにくくなるなどの運動障害をもたらす神経系の難病です。パーキンソン病患者の脳内にはレビー小体というタンパク質と脂質の特徴的な凝集体が存在することがわかっています。戻る
- 注4 多発性硬化症
- 目が見えにくくなったり、筋肉を動かしにくくなったりする神経系の難病です。ミエリン鞘の形成不全が原因ということがわかっています。戻る
- 注5 キラリティ
- 三次元の図形や物体が、その鏡像と重ね合わすことができない性質をしめします。人の左右の掌も鏡像関係を示し、この関係性は分子レベルにも存在します。例えば、タンパク質を構成するアミノ酸には、D型とL型の2種類がありますが、両構造は重ね合わせることができません。戻る
- 注6 ニューラルネットワーク
- 脳の神経回路を模した数理モデルの一つです。この数理モデルにデータを学習させることで、画像をコンピュータに認識させたりすることができます。タンパク質研究の分野では、アミノ酸配列を入力としてαヘリックスやβシートが形成される位置を予測することなど様々な用途に利用されています。戻る
- 注7 二次構造
- タンパク質はそれぞれ異なる構造(三次構造)をしていますが、局所的に見ると、類似した構造が見られます。このタンパク質が共通して持っている構造のことを二次構造と呼んでいます。代表的な二次構造として、αヘリックス(らせん構造)やβシート(平面的な構造)があります。決まった二次構造をタンパク質がとらない場合、その構造はランダムコイルとして分類されます。戻る
- 注8 アミノ酸配列
- タンパク質やペプチドはおよそ20 種類のアミノ酸の組み合わせにより構成されており、アミノ酸配列とはアミノ酸の並び順を指します。アミノ酸がどのような順序でつながっているかが重要で、この順序がタンパク質の機能や構造を決定します。戻る
- 注9 両親媒性
- 分子が親水性(水に溶けやすい)部分と疎水性(水に溶けにくい)部分を両方持つ性質を示します。タンパク質の二次構造の一つであるαヘリックスは、これを構成する疎水性と親水性のアミノ酸により、親水性と疎水性の領域が立体的に別れて配置された構造となる場合があります。戻る
- 注10 静電的相互作用・疎水的相互作用
- タンパク質が生体膜に結合する際の重要な駆動力として考えられています。静電的相互作用は電荷を持つ粒子間の引力をしめします。タンパク質を構成するアミノ酸や生体膜を構成するリン脂質は電荷を有する場合があり、これらの間で静電的相互作用が働きます。一方で、疎水的相互作用とは、水のような極性溶媒中で、疎水性分子や疎水性部分が集まり、水との接触面積を最小限にしようとする現象をしめします。生体膜はリン脂質の炭素鎖(疎水性)が凝集した疎水領域が、またタンパク質は疎水性アミノ酸が集まった疎水領域があるため、生体膜とタンパク質のそれぞれの疎水領域間で相互作用し凝集しやすくなります。戻る











