⽣理的環境下におけるパーキンソン病誘発物質の形成メカニズムの解明
― たんぱく質が原因となる神経変性疾患 抑制の応⽤に期待―
本研究成果のポイント
- ●パーキンソン病を誘発するたんぱく質“αシヌクレイン(αS)”が神経細胞内シナプス⼩胞膜と結合した構造を⽣理的環境に近い条件で初めて観測
- ●たんぱく質が原因となる神経変性疾患抑制への応⽤に期待
概要
広島⼤学⼤学院先進理⼯系科学研究科の今浦稜太⼤学院⽣、⿃取⼤学⼤学院⼯学研究科の河⽥康志教授、広島⼤学放射光科学研究所(以下「HiSOR」という)の松尾光⼀准教授は、放射光(注1)を利⽤した真空紫外円⼆⾊性分光法(注2)および直線⼆⾊性分光法(注3)による実験と、分⼦動⼒学(以下、「MD」という)シミュレーション(注 4)による理論計算を組み合わせることで、αシヌクレイン(以下、「αS」という)が、神経細胞内の⼩胞膜上で“アミロイド線維(凝集体)”(注5)に変化する直前に形成する分⼦構造を明らかにすることに成功しました。αSは、パーキンソン病(注6)を誘発する物質“アミロイド線維”を形成するたんぱく質であり、この分⼦構造がわかると、アミロイド線維の蓄積が原因と考えられるパーキンソン病、アルツハイマー病、筋萎縮性側索硬化症(注7)などの神経変性疾患の抑制や治療への応⽤が期待できます。
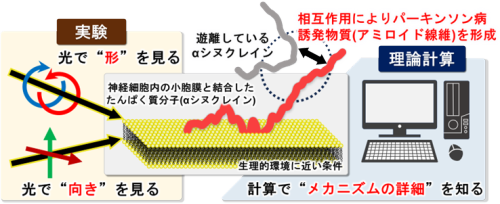
図1 神経細胞内でアミロイド線維を形成する直前のたんぱく質分⼦(αシヌクレイン)
本研究成果は、⽶国の科学誌「Langmuir」に2024年9⽉16⽇付でオンライン掲載されました。
本研究は、科学研究費助成事業(課題番号︓22K06163、23H04597)による⽀援を受けて実施されました。
掲載雑誌︓Langmuir
論⽂タイトル︓“Salt-induced hydrophobic C-terminal region of α-synuclein triggers its fibrillation under the mimic physiologic condition”
著者︓Ryota Imaura, Yasushi Kawata, Koichi Matsuo
掲載⽇︓2024年9⽉16⽇
DOI︓https://doi.org/10.1021/acs.langmuir.4c02178
URL:https://pubs.acs.org/toc/langd5/40/37
広島大学お知らせ
【研究成果】生理的環境下におけるパーキンソン病誘発物質の形成メカニズムの解明 -たんぱく質が原因となる神経変性疾患抑制の応用に期待-
研究の背景
近年、パーキンソン病や筋萎縮性側索硬化症といった神経変性疾患の原因解明に向けた研究が世界中で進められています。これらの疾患は、脳内に異常なたんぱく質が蓄積し、神経細胞がダメージを受けることで発症するとされています。その中でも、⾼齢化が進む国内において、近年急増しているパーキンソン病の原因として注目されているのが「αシヌクレイン(αS)」というたんぱく質です。
αSは、通常、脳の神経細胞内に存在し、神経伝達の調整をサポートする役割を果たしています。しかし、何らかの原因でαSが異常な形態をとり、アミロイド線維という繊維状の凝集体を形成すると、神経細胞に有害な影響を与え、神経細胞の死滅や症状の進⾏を引き起こし、パーキンソン病の原因となることがわかっています。よって、アミロイド線維の形成機構を解明することは、疾病メカニズムの理解や治療法を開発する上でも役⽴ちます。具体的には、αSが神経細胞内のシナプス⼩胞膜という膜に結合すると、ヘリックス構造(注8)という構造に変化します。その後、シナプス⼩胞膜上でαSが異常蓄積してストランド構造(注8)から成るアミロイド線維が形成されます(図2)。アミロイド線維の毒性や形成速度は、シナプス⼩胞膜に最初に結合したαSの構造に強く依存するため、この構造を明らかにすることが重要です。しかしシナプス⼩胞膜と結合したαSの構造は、非常に複雑で観測が難しく、アミロイド線維がどのように形成されるのかについては不明な点が多く存在しています。また⽣体内に普遍的に存在するNaClなどの塩は、アミロイド線維の形成に⼤きな影響を与えますが、どのようなメカニズムで寄与しているかについては未だ明らかではありません。
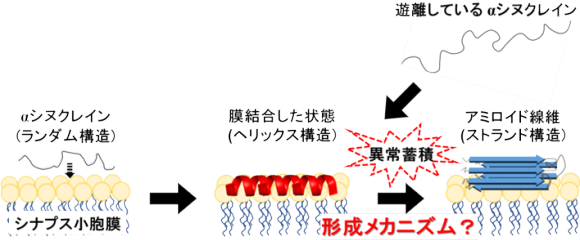
図2 これまでに提案された神経細胞内のαSが⽣体膜と結合した状態からアミロイド線維に構造変化する際の経路
そこで本研究ではシナプス⼩胞模倣膜と塩が存在する⽣理的環境に近い条件下で、膜と結合したαSについて真空紫外円⼆⾊性分光測定および直線⼆⾊性分光測定を⾏い、得られた結果をMDシミュレーションを⽤いて解析することにより、αSが膜結合した構造を分⼦レベルで観測し、アミロイド線維形成にとって重要な領域およびその形成メカニズムを明らかにすることを試みました。
研究の成果
初めに、NaCl(塩)がある時とない時で、シナプス⼩胞模倣膜上でのαSのアミロイド線維の形成を、ThT蛍光測定(注9)を⽤いて観測した結果、塩がアミロイド線維形成を促進することを確認しました(図3)。
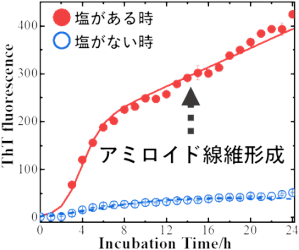
図3 ThT蛍光測定によるアミロイド線維形成の時間変化観測(⻘⾊︓塩がない時、⾚⾊︓塩がある時)
つぎにαSの線維形成メカニズムを解明するために、HiSORに設置された真空紫外円⼆⾊性装置を⽤いて、NaCl(塩) がある時とない時で、シナプス⼩胞模倣膜と結合したαSの構造を観測しました。塩の有無にかかわらず、⽣体膜と結合するとαSがランダム構造(注8)からヘリックス構造(注8)に変化することが分かりました。しかし、塩がある時は、ない時と⽐較して、ヘリックス構造の量が減少することが分かりました(図4A)。また直線⼆⾊性測定から、ヘリックス構造とチロシン残基の膜表⾯との相互作⽤は、塩の存在により減少することが分かりました(図4B)。αS の1-60番目のアミノ酸領域および96-140番目のアミノ酸領域の膜相互作⽤の様⼦をMDシミュレーションによって個別に解析した結果、それぞれの領域が塩の有無にかかわらずヘリックス構造とランダム構造を形成することが分かりました。また、興味深いことに、ランダム構造を形成する96-140番目の領域内のチロシン残基などの⽔を避ける性質を持つアミノ酸残基は、塩がない時に膜相互作⽤に関与する⼀⽅、塩がある時には関与しないことが明らかになりました(図4C)。以上の結果から、膜相互作⽤が弱くランダム構造を形成する96-140番目のアミノ酸領域内で膜相互作⽤に関与しない⽔を避ける性質を持つアミノ酸残基の溶媒への露出が、塩がある時に増加し、溶媒中の遊離αSとの相互作⽤を促進させ、アミロイド線維形成を誘発することが明らかになりました(図5)。
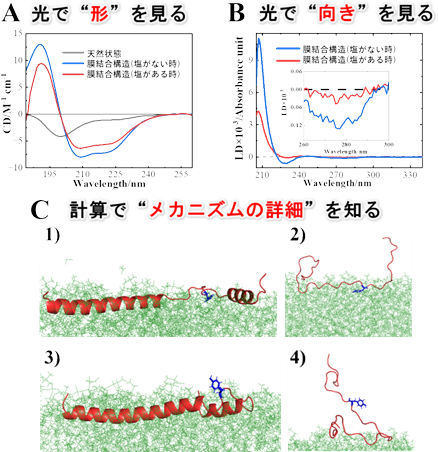
図4 (A) 天然構造(灰⾊)、膜結合構造(⻘⾊︓塩がない時、⾚⾊︓塩がある時)の円⼆⾊性スペクトル(B)αSの膜結合構造(⻘⾊︓塩がない時、⾚⾊︓塩がある時)の直線⼆⾊性スペクトル。挿⼊図は280nm付近(チロシン残基由来のシグナル)を拡⼤したもの (C)(1,3)αSの1-60番目のアミノ酸領域(⻘⾊はチロシン残基:Y39)と(2,4) 96-140番目のアミノ酸領域(⻘⾊はチロシン残基:Y125)の⽣体膜との相互作⽤についてのMDシミュレーションの結果
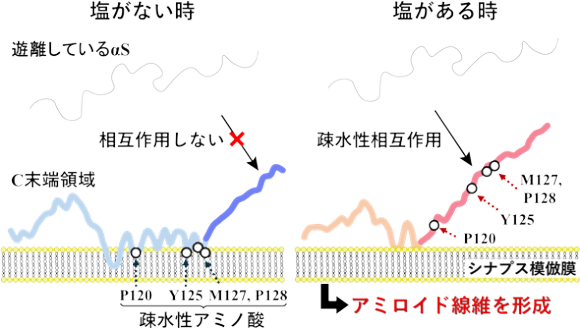
図5 本研究結果をもとに提案されたαS(96-140番目のアミノ酸領域)の膜結合構造と線維形成を促進させる分⼦間相互作⽤のモデル。塩の影響により、⽔を避ける性質を持つアミノ酸残基(Y125等)を多く含む領域が、溶媒に露出すると、遊離しているαSとの分⼦間相互作⽤を誘発し、アミロイド線維形成が促進される。
今後の展開
本研究では、実験と理論計算を組み合わせることで、パーキンソン病の誘発物質であるアミロイド線維が形成される前の⼩胞模倣膜と結合したαSの分⼦構造を明らかにすることで、線維形成において重要な領域が96-140番目のアミノ酸領域にも存在することを明らかにしました。本研究成果は、⽣体膜上のαSの構造とアミロイド線維形成との関係を分⼦レベルで解明するものです。アミロイド線維が関連する疾患を制御する研究に応⽤でき、アルツハイマー病や筋萎縮性側索硬化症など疾病メカニズムの解明や治療戦略に貢献することが期待されます。
用語解説
- 注1 放射光
- ほぼ光速で運動する電⼦の進⾏⽅向が磁⽯によって変えられた際に発⽣する電磁波であり、シンクロトロン放射とも呼ばれます。⾚外からX線にわたる広い波⻑の電磁波を含む強⼒な光源であり、固体物理や⽣体物質構造研究をはじめ、物理・⽣物・化学など幅広く利⽤されています。戻る
- 注2 真空紫外円⼆⾊性分光
- たんぱく質などの⽣体分⼦は、三次元の図形や物体が、その鏡像と重ね合わすことができないキラリティと呼ばれ る性質を持ちます。キラリティがある分⼦は、左円偏光と右円偏光と呼ばれる特殊な光の吸収量に差があり、それを円⼆⾊性と呼びます。光の波⻑を変えながら円⼆⾊性の⼤きさや符号を測ったものを円⼆⾊性スペクトルと呼びます。円⼆⾊性スペクトルの形状はタンパク質の⼆次構造を敏感に反映するので、塩や⽣体膜存在下などの様々な条件で測定した円⼆⾊性スペクトルを⽐較することで、たんぱく質の構造がどのように変化したのかを知ることができます。本研究で⽤いた真空紫外円⼆⾊性分光は、光源に放射光を⽤いており、市販の装置では測定困難な⾼エネルギー領域である真空紫外領域まで円⼆⾊性スペクトルの測定範囲を広げることが可能であり、タンパク質の⼆次構造について詳細な情報を得ることができます。戻る
- 注3 直線⼆⾊性分光
- 直線⼆⾊性とは物質に直線偏光を照射し、垂直と平⾏の偏光に対して吸収の差が⽣じる現象のことを指します。たんぱく質が⽣体膜と結合するとき、しばしば特定の⽅向を向いて並び、これを配向と呼びます。配向は、たんぱく質の機能に重要であり、分⼦の形状や電荷分布、膜との相互作⽤によって決定されます。例えば、ヘリックス構造を持つたんぱく質は、その⼆次構造の配向に依存して異なる直線⼆⾊性スペクトルを⽰し、分⼦が膜の⾯に対して平⾏か垂直かといった情報を得ることが出来ます。戻る
- 注4 分⼦動⼒学(MD)シミュレーション
- 原⼦や分⼦の動きを計算により導き出すコンピュータシミュレーションの⼿法です。近年では、コンピュータの性能向上やソフトウェアのアルゴリズムの改良により、⽣体分⼦などの⾼分⼦の⻑時間シミュレーションが可能になりつつあります。戻る
- 注5 アミロイド線維
- アミロイド線維は、たんぱく質が正しく折りたたまれずに異常に集まってできた不溶性かつ繊維状の物質です。細胞にとって有害で、神経細胞などの働きを妨げることがあり、多数集合すると細胞にダメージを与え、病気を引き起こします。戻る
- 注6 パーキンソン病
- パーキンソン病は歩⾏しにくくなるなどの運動障害をもたらす神経系の難病です。パーキンソン病患者の脳内には レビー⼩体というたんぱく質と脂質の特徴的な凝集体が存在することはわかっています。戻る
- 注7 筋萎縮性側索硬化症
- 筋萎縮性側索硬化症(ALS)は、体の筋⾁を動かすために必要な神経が徐々に働かなくなっていく神経系の難病です。ALSではいくつかのたんぱく質が正しく折りたたまれず、異常に蓄積します。これが神経細胞を傷つけ、最終的に筋⾁を動かす信号がうまく伝えられなくなります。戻る
- 注8 ⼆次構造
- たんぱく質はそれぞれ異なる構造をしていますが、局所的に⾒ると、類似した構造が⾒られます。このたんぱく質が共通して持っている構造のことを⼆次構造と呼んでいます。代表的な⼆次構造として、ヘリックス(らせん構造)やストランドあるいはシート(平⾯的な構造)があります。決まった⼆次構造をたんぱく質がとらない場合、その構造はランダムコイルとして分類されます。戻る
- 注9 ThT蛍光測定
- ThT蛍光測定は、アミロイド線維の量を調べるための⽅法です。ThT(チオフラビンT)という蛍光⾊素は、アミロイド線維と結びつくと光を放つ性質を持っています。この性質を利⽤して、アミロイド線維がどのくらいあるかを蛍光で測定することができます。戻る











